

Цель моего выступления — изложить принципы, касающиеся роста и сокращения жировых клеток. Основной аспект этой темы — возможность скорректировать ожирение, но я не хотел, чтобы это было основной целью. Вместо этого я предлагаю рассмотреть проблему на уровне отдельных жировых клеток, поскольку именно здесь происходит множество процессов и проявляются нюансы, которые упускаются из виду, если мы рассматриваем лишь общую жировую массу. Чтобы понять важность этой темы, объясню, почему я, как учёный, изучающий инсулинорезистентность, уделяю столько внимания жировым клеткам. В действительности, можно сказать, что я учёный, который занимается жировыми клетками и исследует их связь с инсулинорезистентностью.
Из всех тканей и типов клеток, с которыми мы работаем в моей лаборатории – будь то нейроны, мышцы или жировая ткань – чаще всего мы имеем дело именно с жировыми клетками. Эти две проблемы тесно связаны из-за их широкого распространения: примерно половина взрослого населения мира страдает избыточным весом, и более половины имеет малоизвестную проблему — инсулинорезистентность. Вы, конечно, знакомы с этим гораздо лучше, чем обычная аудитория. За последние семь лет я с удовольствием наблюдал, как меняется отношение к этой теме. Когда я впервые выступал перед широкой публикой, об инсулинорезистентности почти не говорили, но теперь она обсуждается открыто. Почему же так важно говорить об этом? Помимо распространённости, проблема инсулинорезистентности крайне актуальна, поскольку она способствует развитию всех так называемых «болезней цивилизации» или «болезней процветания».
Практически каждое хроническое заболевание — это, образно говоря, ростки, произрастающие из одной и той же «отравленной почвы». Вместо того чтобы постоянно обрезать эти ветви, я увлечённо фокусируюсь на инсулинорезистентности, потому что, если мы сможем исправить корень проблемы, мы решим все вытекающие из неё последствия, вместо того чтобы тратить усилия на борьбу с множеством отдельных заболеваний. `Как тело, или жировая ткань, способствует развитию инсулинорезистентности?`
Вы, вероятно, уже слышали об этом, но я хочу напомнить и перейти от общей жировой массы к уровню отдельных жировых клеток. Увеличение жировой массы может происходить двумя способами. С одной стороны, человек может набирать жир из-за роста всех существующих жировых клеток – этот процесс называется гипертрофией. С другой стороны, можно набрать ту же массу жира не за счёт значительного изменения размера жировых клеток, а за счёт добавления или создания новых жировых клеток – этот процесс называется гиперплазией.
Таким образом, гипертрофические жировые клетки малочисленны, но значительно больше по объёму и размеру. Гиперпластические же жировые клетки гораздо многочисленнее, но, как правило, меньше по размеру и объёму. Гипертрофические жировые клетки — это «больные» клетки. Они способствуют развитию заболеваний, особенно в контексте инсулинорезистентности, по двум причинам. Первая причина заключается в том, что гипертрофическим жировым клеткам не хватает места. Это похоже на метаболическую гостиницу, куда продолжают заселяться гости, но количество номеров ограничено. У гипертрофической жировой ткани конечное число жировых клеток, и мы не можем добавить новые. Мы продолжаем «заселять» всё больше «гостей», но «менеджер гостиницы» отказывается выпускать их из комнат. В итоге люди начинают просачиваться через окна, несмотря на попытки менеджера остановить их. Эта аналогия очень точно описывает взаимодействие инсулина с гипертрофической жировой клеткой.
Инсулин пытается заставить жировую клетку накапливать всё больше и больше жира. Однако клетка достигает максимального размера — а он может быть значительным, и я чуть позже приведу конкретные цифры, чтобы вы оценили масштаб. Но существует физический предел того, насколько большой может стать клетка, прежде чем её мембрана, насыщенная липидами и белками, начнёт разрушаться. Именно в этот момент гипертрофическая жировая клетка начинает «говорить» инсулину: «Ты хочешь, чтобы я продолжала расти, но я больше не могу тебя слушать, потому что лопну. Поэтому я начну выделять жиры, хотя ты пытаешься этому помешать». Иными словами, инсулин пытается подавить липолиз, но гипертрофическая жировая клетка игнорирует его и активирует липолиз, даже когда уровень инсулина высок и пытается его остановить. При повышении уровня свободных жирных кислот и инсулина эти кислоты начинают накапливаться в других тканях, не относящихся к жировой. Это называется эктопическим или внеадипозным запасом жира.
Одновременно с тем, как жировая клетка, претерпевшая такую гипертрофию, начинает сопротивляться дальнейшему росту, она становится настолько большой, что отдаляется от капилляров. Капилляры — это рабочая часть сосудистой системы, именно на их уровне происходит обмен веществ: кислорода, углекислого газа и других соединений. В стенках артерий, вен, артериол и венул такой обмен не происходит. Таким образом, капилляры — это мельчайшие сосуды, где осуществляется микроциркуляция. Для нормального функционирования клетка должна находиться в пределах нескольких десятков микрометров от капилляра, чтобы получать кислород и питательные вещества, а также выделять продукты обмена, такие как CO2. Вот, например, две маленькие жировые клетки, каждая из которых находится в пределах нескольких десятков микрометров от капилляра. Однако гипертрофическая жировая клетка может стать в десятки и сотни раз крупнее обычной, достигая диаметра до 300 микрометров, а её объём увеличивается ещё больше.
Таким образом, даже небольшая популяция гипертрофированных адипоцитов может оказаться слишком далеко от капилляров. В результате гипертрофированная жировая клетка, находясь так далеко от капилляра, начинает страдать от недостатка кислорода — она становится гипоксической. Стремясь исправить это состояние, жировая клетка становится провоспалительной, выделяя в кровь множество провоспалительных цитокинов и белков. Некоторые из них стимулируют синтез новых капилляров, тем самым корректируя гипоксию. В итоге, мы должны понимать, что гипертрофические жировые клетки, пытаясь обеспечить своё выживание, начинают ограничивать собственный рост и становиться провоспалительными для улучшения кровотока. Эти два процесса в конечном итоге способствуют развитию заболеваний во всём остальном теле. Сама жировая клетка лишь пытается выжить, а остальной организм становится невольной жертвой, страдающей от побочных эффектов.
Понимание роста жировых клеток, независимо от общей жировой массы, позволяет ввести концепцию, имеющую ключевое значение для понимания жировой массы и метаболических нарушений, — это «индивидуальный жировой порог». Уверен, многие из вас, если не все, слышали об этой концепции. Идея индивидуального жирового порога заключается в том, что каждый организм, в зависимости от своей способности образовывать новые жировые клетки (гиперплазия), имеет определённый объём жира, который он может безопасно хранить, прежде чем гипертрофические жировые клетки достигнут своего предела. Этот жировой порог — своего рода лимит. Если у человека этот порог высок, и его жировые клетки могут быть большими, но на данный момент они лишь небольшого размера, такой человек будет инсулиночувствительным. Напротив, если размер жировых клеток превысил установленный в данном организме порог, определяемый генетической предрасположенностью к росту новых жировых клеток, то этот порог оказывается преодолённым.
Клетки стремились вырасти до определённого размера, достигли его и теперь пытаются увеличиться ещё больше. В таком случае они, без сомнения, будут развивать инсулинорезистентность. `Что произойдёт, если увеличить индивидуальный жировой порог у человека с инсулинорезистентностью, стимулировав создание новых жировых клеток?`
Если взять человека с инсулинорезистентностью, который достиг своего индивидуального жирового порога, и увеличить этот порог за счёт увеличения способности организма к гиперплазии, то есть к созданию новых жировых клеток, что произойдёт с его порогом? Он начнёт расти. Таким образом, порог увеличивается, пока человек фактически толстеет. Другими словами, поскольку вы позволили организму накапливать больше жира в жировой ткани, порог увеличился. Именно это происходит при применении класса противодиабетических препаратов, называемых тиазолидиндионами или ТЗД. Эти препараты парадоксальным образом делают человека более полным, но при этом более чувствительным к инсулину.
Они становятся более инсулиночувствительными, потому что эти препараты позволяют им хранить больше жира за счёт активации гиперплазии. Интересно наблюдать за различиями в наборе жировой массы у разных этнических групп по всему миру. Одной из причин, по которой я проводил свои постдокторские исследования в Сингапуре, был интерес правительства к этим различиям. В одном исследовании, где сравнивали биопсии жировой ткани у европейцев (кавказцев) и выходцев из Южной Азии, исследовался размер жировых клеток при одинаковой процентной доле жировой массы. Было обнаружено, что у европейцев гораздо больше и значительно меньше по размеру жировых клеток по сравнению с представителями Южной Азии, у которых клеток было значительно меньше, но они были намного крупнее. `У какой популяции, исходя из этих данных биопсии, будет более высокий порог жировой массы?`
У европейской популяции, потому что их жировые клетки намного меньше и многочисленнее, при этом общая жировая масса у них такая же.
Поэтому неудивительно, что в среднем южноазиатское население, как в этом исследовании, так и в целом, чаще страдает от инсулинорезистентности по сравнению с европейским населением. `Какими, по вашим прогнозам, будут уровни инсулина натощак у этих групп, зная, что ключевым признаком инсулинорезистентности является повышенный уровень инсулина?`
У европейцев средний уровень инсулина натощак составляет около 9-10 микроединиц на миллилитр, тогда как у выходцев из Южной Азии он значительно выше. Мы обсудили проблему роста жировых клеток и важность их размера. Теперь рассмотрим факторы, способствующие их сокращению, что также актуально в контексте инсулинорезистентности и потери веса. Для роста жировой клетки необходимы два аспекта: повышенный уровень инсулина и достаточное количество энергии. Иными словами, инсулин — это сигнал, который указывает жировой клетке расти, а калории или энергия — это необходимое «топливо» для этого роста.
Сигнал роста сам по себе недостаточен; должно быть и топливо. Однако, как я объясню далее, если уровень энергии высок, но отсутствует стимул в виде инсулина, жировые клетки буквально не знают, что делать с имеющейся энергией. Сначала сосредоточимся на энергетическом, или калорийном, аспекте. Для роста жировая клетка может использовать два источника энергии: глюкозу и жиры, обычно в форме триглицеридов, которые поступают в виде различных липопротеинов, таких как ЛПНП или ЛПОНП. Это то, что поступает внутрь и питает растущую жировую клетку. С другой стороны, жировая клетка может отдавать своё содержимое в виде свободных жирных кислот посредством липолиза. Измерение свободных жирных кислот всегда указывает на продукты липолиза, исходящие из жировой клетки. Идея о том, что жировая клетка растёт, если энергии из глюкозы или жиров поступает больше, чем расходуется, лежит в основе калорийной теории ожирения.
Согласно ей, набор или потеря веса, а также рост или сокращение жировых клеток полностью зависят от баланса между поступающей и расходуемой энергией. `Однако как регулируется этот баланс между притоком и оттоком энергии?`
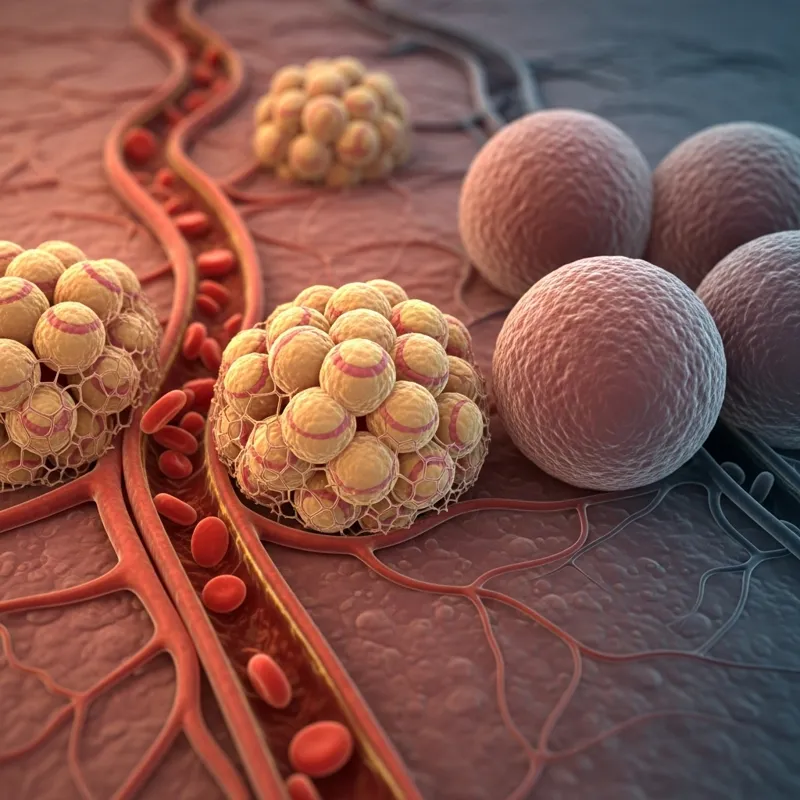
Возьмём, например, физическую нагрузку. Во время тренировки происходят интересные изменения уровней энергии в крови. Источниками энергии в крови являются глюкоза, триглицериды, свободные жирные кислоты, а также лактат и кетоны. При физической нагрузке уровень свободных жирных кислот значительно повышается, что ожидаемо, поскольку жировые клетки отдают свою энергию. Однако, как жировая клетка «узнаёт», что мышцы работают? Как жировая ткань понимает, что сейчас есть метаболическая потребность, и нужно перевести жир из запасов в мышцы? В то же время, пока жир увеличивает количество свободных жирных кислот, в крови становится ещё больше глюкозы.
Любой, кто использует непрерывный мониторинг глюкозы, знает, что во время физической активности уровень глюкозы часто повышается. `Почему же тогда жировая клетка не поглощает эту глюкозу во время тренировки? И почему она, по сути, начинает «голодать»?`
Она не поглощает, потому что ей нужен соответствующий сигнал. Сигналом для жировой клетки, чтобы она высвобождала больше энергии, являются гормоны. Даже при изобилии энергии в крови во время физической нагрузки, жировая клетка не просто «не может» её использовать — она не знает, что с ней делать. Клетка не обладает врождённым знанием о том, что делать с окружающей энергией. Она может буквально плавать в море энергии, но без гормонального стимула она не будет знать, как ею распорядиться. Гормоны являются основным посредником, который указывает клетке, особенно жировой, что делать с энергией, которая находится вокруг неё и внутри неё. Теперь оставим энергию в стороне и сосредоточимся на инсулине как стимуляторе роста жировых клеток.
Напомню, что именно рост жировых клеток способствует инсулинорезистентности, которая, в свою очередь, приводит к метаболическим заболеваниям. Таким образом, эта концепция выходит за рамки простого набора или потери веса, она непосредственно затрагивает риск развития хронических заболеваний. При повышенном уровне инсулина происходит активный рост жировых клеток за счёт двух основных механизмов. Во-первых, инсулин увеличивает поглощение энергии, а во-вторых, он регулирует вывод или высвобождение энергии из жировой клетки. Повышение уровня инсулина способствует поглощению глюкозы жировыми клетками. Без увеличения инсулина этот процесс невозможен. Глюкоза поступает в жировую клетку, и клетка точно знает, что с ней делать, потому что инсулин дал ей указания. Инсулин не просто «провожает» глюкозу внутрь, но и активирует все ферменты, участвующие в липогенезе – синтезе жира из углеродных атомов глюкозы.
Таким образом, когда уровень инсулина высок, он непосредственно направляет глюкозу в клетку и указывает ей превращать её в жир. Теперь о липидах. Некоторые могут утверждать, что различные уровни инсулина не влияют на поступление жира в жировую клетку, ссылаясь на определённые исследования. Это отчасти верно, однако для того, чтобы этот процесс вообще происходил, инсулин необходим. Даже при отсутствии инсулина существует некоторая способность жира проникать в клетку, но повышенный уровень инсулина значительно увеличивает экспрессию липопротеинлипазы. Липопротеинлипаза — это фермент, который находится в капиллярах и определяет, где будет накапливаться жир в организме. На активность липопротеинлипазы влияют и другие гормоны, например, половые. Именно поэтому, хотя мужчины и женщины могут накапливать одинаковое количество жира, расположение этих жировых отложений различается под влиянием половых гормонов, что опосредовано экспрессией липопротеинлипазы.
Таким образом, инсулин необходим для экспрессии липопротеинлипазы в жировой ткани, хотя для этого и не требуется его высоких концентраций. Вторая часть механизма действия инсулина заключается в снижении выработки энергии, то есть свободных жирных кислот. Инсулин мощно подавляет липолиз. Поэтому, если уровень инсулина в крови резко повышается, например, после еды, уровень свободных жирных кислот падает. Спустя несколько часов, когда человек переходит в фазу голодания, определяемую снижением уровня инсулина, свободные жирные кислоты начинают расти. Доктор Кэхилл, известный учёный, изучавший голодание много десятилетий назад, назвал инсулин гормоном сытого состояния. Если уровень инсулина повышен, это не состояние голодания. Это определение, которое я в целом поддерживаю, лежит в основе эндокринной теории ожирения или эндокринной теории роста жировых клеток.
Согласно ей, если уровень инсулина повышен, он блокирует выход энергии и увеличивает её поступление, тем самым способствуя росту жировых клеток. В поддержку эндокринной теории существуют реальные данные. В моей лаборатории студенты выращивают жировые клетки в чашках Петри. Эти клетки день за днём остаются очень маленькими, почти неотличимыми от мышечных клеток при наблюдении под микроскопом. И это несмотря на то, что они находятся в среде, богатой жирами и глюкозой, то есть в изобилии энергии. `Почему же они не растут?`
Потому что в культуральной среде нет инсулина. В тот момент, когда мы начинаем добавлять инсулин, клетки «узнают», что им делать, и начинают расти. Им необходим этот сигнал для стимуляции роста. Это абсолютный факт физиологии и клеточной биологии: жировые клетки не могут расти, если уровень инсулина не повышен. Это невозможно.
`Что произойдёт, если снизить уровень инсулина в организме, но сохранить высокий уровень энергии?`
Если инсулин низок, а энергия ntна, первое, что происходит, это увеличение метаболической скорости или расхода энергии. В то же время, при низком инсулине человек начинает сжигать жир настолько интенсивно, что буквально не может остановиться. Печени, например, требуется определённое количество энергии для выполнения своей работы, и обычно количество сжигаемой энергии соотносится с потребностями клетки. Однако, когда инсулин низок, печень удовлетворяет свои энергетические потребности, но не может прекратить сжигать жир. Это приводит к своего рода «выпускному клапану» — синтезу кетонов. Организм может буквально «выбрасывать» эти кетоны в атмосферу. Кетоны имеют калорийность, сравнимую с глюкозой. Таким образом, каждый выдох ацетона или моча на ацетоновой полоске — это молекулы, которые имели калорийную ценность в организме.
Согласно термодинамическим пуристам, они могли быть только сожжены в результате физических упражнений или сохранены. Но здесь мы сталкиваемся с концепцией «расточительства энергии». Это подтверждается моделью человека с «нокаутом» инсулина — то есть с генетическим отсутствием способности производить инсулин, что наблюдается при сахарном диабете 1 типа. Эта область исследований началась для меня несколько лет назад, когда я наткнулся на одну работу. В начале 1900-х годов исследования не публиковались как отдельные рецензируемые рукописи, а скорее представляли собой объёмные данные, собранные в небольшие брошюры. Именно такой работой стало исследование метаболизма при тяжёлом диабете, проведённое двумя выдающимися учёными в своих областях: Эллиотом П. Джослином, чей вклад в эндокринологию до сих пор очевиден благодаря Диабетическому центру Джослина, и Фрэнсисом Г. Бенедиктом, чьи работы легли в основу нашего понимания метаболической скорости.
Возможно, некоторые из вас изучали уравнение Бенедикта — это его заслуга. Эти два исследователя объединили свои усилия и обнаружили, что люди с тем, что мы сейчас называем диабетом 1 типа, имели метаболическую скорость примерно на 20% выше нормы. Они «сжигали» энергию слишком интенсивно, расточительно, не соответствуя размеру своего тела. В середине 1980-х годов другая группа в США провела исследование метаболической скорости у людей с впервые диагностированным диабетом 1 типа и снова обнаружила, что их метаболическая скорость была примерно на 20% выше. Как только им назначили инсулиновую терапию, метаболическая скорость немедленно нормализовалась. Исследователи обнаружили, что с момента инъекции инсулина метаболическая скорость начинала снижаться каждую минуту. Подобное происходит всякий раз, когда уровень инсулина повышается, что прекрасно показано в работах доктора Дэвида Людвига из Гарварда.
Это касается не только диабета 1 типа, но и диабета 2 типа, когда пациенты начинают инсулиновую терапию — их метаболическая скорость также замедляется. Этот факт становится трагическим явлением, когда его используют вновь диагностированные пациенты с диабетом 1 типа. Они считают, что инъекции инсулина делают их полными, и поэтому намеренно занижают дозу инсулина. Представьте соблазн: молодой подросток ест всё, что хочет, потребляя тысячи калорий без контроля, и при этом остаётся худым. Конечно, он чувствует себя ужасно, у него кетоацидоз и массовая гипергликемия, но он тонкий. Затем он начинает инсулиновую терапию, и происходит две вещи: он начинает есть меньше и набирает вес, что вызывает дискомфорт. Соблазн для человека с диабетом 1 типа — просто наслаждаться шоколадным тортом сколько угодно и не колоть себя с помощью иглы. Конечно, последствия такого поведения катастрофичны, но с их точки зрения, они выглядят прекрасно.



















 Заварные блины
Заварные блины Национальные блины
Национальные блины Овсяные блины
Овсяные блины Блины
Блины Дрожжевые блины
Дрожжевые блины Творожные блины
Творожные блины Тонкие блинчики
Тонкие блинчики Оладьи
Оладьи Панкейки
Панкейки Блинные пироги и торты
Блинные пироги и торты








